El agua es un elemento esencial y enigmático
 En nuestro planeta existen organismos capaces de vivir sin luz, incluso sin oxígeno, pero ninguno puede vivir sin agua; llegado el caso, un ser humano podría vivir bastantes días sin comer, pero sólo de 2 a 5 días sin agua. De hecho, aunque perdiéramos casi toda la grasa y la mitad de las proteínas de nuestro cuerpo, podríamos seguir vivos, pero perdiendo tan sólo un 1 o 2% del agua corporal, tendríamos serios problemas con la termorregulación y en el funcionamiento de los sistemas cardiovascular y respiratorio, limitándose notablemente la capacidad física y mental, llegando a alcanzar un riesgo extremo si la deshidratación va más allá.
En nuestro planeta existen organismos capaces de vivir sin luz, incluso sin oxígeno, pero ninguno puede vivir sin agua; llegado el caso, un ser humano podría vivir bastantes días sin comer, pero sólo de 2 a 5 días sin agua. De hecho, aunque perdiéramos casi toda la grasa y la mitad de las proteínas de nuestro cuerpo, podríamos seguir vivos, pero perdiendo tan sólo un 1 o 2% del agua corporal, tendríamos serios problemas con la termorregulación y en el funcionamiento de los sistemas cardiovascular y respiratorio, limitándose notablemente la capacidad física y mental, llegando a alcanzar un riesgo extremo si la deshidratación va más allá.
Cuando se compara con otras moléculas de similar peso molecular y composición, encontramos que el agua tiene propiedades físicas únicas, que son consecuencia de su naturaleza bipolar y de su capacidad para enlazar con otras moléculas mediante enlaces muy peculiares, como son los llamados enlaces por puente de hidrógeno. Es bien sabido que el agua es un compuesto químico formado por dos átomos de hidrógeno (H) y uno de oxígeno (O). Pero lo que no es tan sabido es que cuando el oxígeno y el hidrógeno se unen lo hacen de una forma un tanto especial.
El oxígeno “se apropia” de los electrones, que son atraídos más fuertemente por el átomo de oxigeno que por el de hidrógeno, así los electrones de los dos hidrógenos quedan desplazados hacia el átomo de oxígeno, como consecuencia, el oxígeno queda cargado negativamente y los hidrógenos positivamente. Por eso resulta que la molécula de agua tiene una naturaleza bipolar (tiene un extremo positivo y otro negativo, como ocurre con las pilas eléctricas, o con los imanes). Las moléculas del agua permanecen enlazadas por una relación molecular denominado enlace de hidrógeno.
Normalmente un átomo de hidrógeno solo puede formar a la vez un enlace covalente con otro átomo. Sin embargo un átomo de hidrógeno unido covalentemente puede formar un enlace adicional: un puente de hidrógeno esto es, una asociación débil entre un átomo electronegativo (aceptor) y un átomo de hidrógeno covalentemente unido a otro átomo (donante). Los puentes de hidrógeno son de importancia fundamental para la vida sobre la Tierra, porque todas las formas vivas requieren ambientes en los que, de una forma u otra, el agua está presente.
Una de las consecuencias de esto es que las moléculas se mantienen a una cierta distancia unas de otras, porque si se aproximan demasiado no pueden establecer los enlaces. Así que el agua líquida tiene mucho espacio vacío entre sus moléculas. A diferencia de la mayoría de las sustancias, que se contraen cuando se congelan, el agua es tan rara que al congelarse aumenta de volumen disminuyendo de este modo su densidad, que es máxima a 4 ºC. Esta propiedad evita que los océanos de las regiones polares de la Tierra se congelen por completo. Puesto que el hielo, al flotar en el agua, protege de la congelación a las aguas más profundas, protegiendo con ello la vida marina; y esto ocurre, no sólo en mares y océanos, sino incluso en cualquier rio, lago o hasta en un simple estanque de un parque público.
Con total seguridad, el agua es un líquido muy, muy extraño. De este elemento dice Marcia Barbosa, profesora de Física en la Universidad Federal de Rio Grande del Sur (Brasil), que tiene 67 anomalías, que le hacen comportarse de forma diferente a los líquidos que podríamos considerar normales. Además, la mayoría de sus rarezas están ligadas con la vida, con el planeta e incluso con nuestra propia supervivencia. Si el agua fuera un líquido normal, sin esas anomalías, y obedeciera a las leyes habituales de la hidrodinámica, probablemente no existirían los seres vivos.
Además de la ya citada anomalía de su mayor densidad a los 4 ºC, otra rareza es su calor específico, que al ser muy elevado hace que los océanos sean capaces de almacenar enormes cantidades de energía, gracias a lo cual esos océanos son grandes reguladores de la temperatura del planeta Tierra, lo que ayuda a proteger la vida, que no soporta bien las grandes variaciones térmicas. Nosotros mismos, los seres humanos, somos alrededor de un 80% agua y aprovechamos su calor específico para regular nuestra propia temperatura.
Por su capacidad para formar puentes de hidrógeno con otras sustancias, el agua es el líquido que más sustancias es capaz de disolver, de hecho es el mejor disolvente conocido. El agua, es el medio que permite el movimiento de las moléculas dentro de las células y entre ellas. En el caso de las plantas, la corriente de agua absorbida por las raíces, también es el medio para conducir las sales minerales capturadas en el suelo hacia la superficie de la raíz donde son absorbidas y distribuidas, también gracias al agua, por toda la planta. La gran capacidad disolvente del agua permite funciones importantes para los seres vivos, como el aporte de nutrientes y la eliminación de desechos, que se realizan a través de sistemas de transporte acuosos.
Es sabido que la evaporación del agua enfría los cuerpos, al disipar el calor. Las plantas continuamente absorben y pierden agua, de forma que, en días secos y soleados, una hoja puede renovar todo su contenido de agua en una hora. El calor se disipa porque las moléculas de agua que escapan a la atmósfera, son las que tienen mayor energía, lo que les permite romper los enlaces que las retienen. Cuando las moléculas escapan, atrás dejan las moléculas con menor energía y por tanto dejan un cuerpo más frío. Para una hoja vegetal típica casi la mitad del calor neto que le entra con la radiación solar se disipa por transpiración.
En cualquier sustancia, las fuerzas que enlazan moléculas, tal como ocurre con los puentes de hidrógeno en el agua, son llamadas fuerzas cohesivas y las fuerzas que enlazan a la sustancia con una superficie se llaman fuerzas adhesivas. Pues bien, otra interesante peculiaridad del agua es la de que, colocada en un capilar se adhiere a las paredes de éste, debido a que las fuerzas adhesivas entre el agua y las paredes del capilar son mayores que las fuerzas cohesivas entre las moléculas de agua. Gracias en buena parte a esa capilaridad, es por lo que se produce en las plantas el ascenso de la savia desde las raíces hasta las hojas.
Resulta también que el agua es transparente a la radiación solar visible, de forma la luz del Sol penetra lo suficiente en el agua, para hacer posibles los procesos de fotosíntesis y crecimiento en las algas, hasta una considerable profundidad. Sin embargo, el agua es casi opaca a longitudes de onda más largas en el rango del infrarrojo, por lo que los filtros de agua tienen buena capacidad para absorber calor y cumplir el cometido regulador de temperaturas que antes mencionábamos.
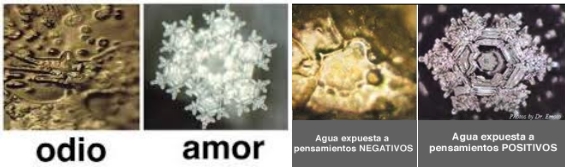
Y por si fueran pocas las propiedades y anomalías asociadas al agua, de las que hemos comentado sólo unas pocas, resulta ahora que hay investigadores, como el japonés Masaru Emoto, que generando y analizando sus cristales de hielo, intentan llegar a demostrar que el agua tiene algún tipo de memoria y que en ella recuerda tanto los sitios donde ha estado o los conductos que ha recorrido, como “el trato que se le ha dado”.
Se llega incluso a afirmar que su estructura, al cristalizar como hielo, depende de las palabras que se le dirigen antes de cristalizar, de forma que ante los insultos adopta estructuras amorfas, de notable fealdad, mientras que tras algunos halagos, su estructura micro cristalina es muy bella. Esto, que podría resultar raro y difícil de aceptar, se dice también de las plantas, e incluso existen experiencias con ellas que parecerían probarlo. Sin embargo, aunque la idea resulta atractiva y sin duda intrigante, no existe base científica suficiente para poder confirmar la existencia de algún tipo de memoria, al menos en el caso del agua.
La existencia y características de los puentes de hidrógeno podría hacer pensar que el agua quizá recuerde con quien ha estado en contacto a través de esos puentes “hace un rato”, pero lo cierto es que las moléculas del agua se olvidan muy rápidamente de sus contactos. Las ligaduras del agua son muy variables y aleatorias, se hacen y deshacen rápidamente. No hay recuerdos ni emociones en ello. Respecto a los ensayos del investigador japonés Emoto, probablemente encontró lo que de antemano quería encontrar. En ciencia son imprescindibles los grupos de control y la estadística, un número suficiente de datos y experimentos que confirmen los resultados.
En todo caso, dado que la vida está llena de sentimientos, dado que prácticamente todos los seres vivos (humanos, animales y plantas) tienen algún tipo de sentimientos, y dado que el agua es la base de la vida… ¿Qué tendría de raro que el agua tuviera también alguna forma de “memoria sentimental”?