La batería de electrolito sólido, el futuro de la movilidad eléctrica
Hoy vamos a explicar como funciona una batería eléctrica y su prometedor futuro.
El funcionamiento de una batería se basa en un reacción química reversible llamado reacción redox (reacción de oxidación reducción), el funcionamiento es muy simple:
Pongamos por ejemplo la oxidación del hierro, si mezclamos hierro (Fe) con Oxigeno (O2) se formará óxido férrico (Fe2O3), pero que es lo que realmente a ocurrido, pues lo que ha pasado es que el hierro ha “conseguido” electrones que le ha cedido el oxigeno. Por ello decimos que el hierro se ha oxidado y el oxigeno se ha reducido.
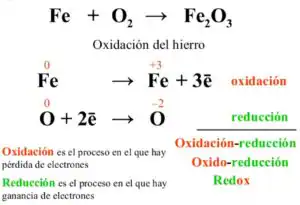
Éste proceso puede ser revertido, si nosotros aplicamos la suficiente energía al óxido férrico (Fe2O3), éste liberará de nuevo los electrones, invirtiendo la reacción.
Con el ejemplo anterior acabamos de hacer una pila, ya que lo que nos interesa es precisamente el movimiento de electrones en un sentido para cargar y en otro para descargar.
Evidentemente no utilizaremos hierro (Fe), sino que buscaremos compuestos que liberen la máxima cantidad de electrones y tengan tendencia a liberarlo, en la tabla periódica, estos elementos se sitúan a la izquierda y son los llamados Alcalinos.
Y ahí se encuentra el Lítio, ¿os suena de algo?.
La química más común para las baterías de litio está formada por un ánodo de litio (polo positivo), el dióxido de manganeso como un cátodo (polo negativa). El problema es que ésto por sí no basta, hace falta algo que facilite el traspaso de iones entre ambas partes sin que lleguen a contactar fisicamente, ese nexo de unión, se denomina electrolito y normalmente es una sal de litio disuelta en un disolvente orgánico.

En la fotografía podemos observar que la batería en sí es la pieza de color verde que está formada por tres capas enrolladas para ocupar menor espacio, las tres capas son ánodo, separador y cátodo.
Con el paso de los ciclos de carga y descarga, el electrolito líquido se va solidificando, y creando ramificaciones (llamadas dendritas) que evoluciona cortocircuitando el ánodo y el cátodo progresivamente, de modo que la batería va perdiendo capacidad.
Además tenemos el problema de que ese electrolito es inflamable en la mayor parte de los casos, con el consiguiente riesgo, de ahí que sean confinadas en contenedores metálicos.
Visto cual es el problema de la batería actualmente, ¿Cual es la solución?.
Pues la solución viene por parte de una eminencia y creador de la batería de litio en 1976, John Bannister Goodenough. Actualmente es profesor de ingeniería mecánica y ciencias de materiales en la Universidad de Texas en Austin y su equipo de investigación, entre las que cabe distinguir a Maria Helena Sousa Soares de Oliveira Braga, doctora y profesora de la Universidad de Oporto.
Éste equipo ha conseguido diseñar un electrolito sólido de cristal amorfo de Sodio, que permite fabricar baterías que no sólo evita la formación de dendritas, sino que tiene numerosas ventajas:
- El sodio es mucho mas barato y abundante que el Litio, lo cual abaratará la fabricación.
- Permitirá utilizar usar ánodos de metal alcalino con litio, sodio o potasio, lo cual podrá incrementar hasta en tres veces la capacidad actual de las baterías.
- Consiguen ser estables hasta temperaturas de -20ºC, lo cual era impensable porque congelaba el electrolito y reducía enormemente su uso.
- Y encima de todo lo anterior, aumenta los ciclos de vida desde 500 hasta mas de 1200 ciclos.
Es tan revolucionaria que todas las empresas automovilísticas están trabajando ya en ellas, e incluso están dando fechas, Toyota apunta al 2022, y tanto Samsung como LG dicen estar muy cerca de conseguirlo, tanto que apuntan al 2019/2020 como el inicio de uso de la tecnología en dispositivos móviles y uno o dos años para verlos en los primeros vehículos.
Un vehículo que posiblemente las monte será el Tesla Roadster de nueva generación ya que los datos anunciados por el fabricante no son posibles con las baterías actuales, si tenemos en cuenta que el paquete actual de la versión 85, pesa 325 kg, para conseguir actualmente 200kwh necesitaríamos mas de 525 kg en baterías lo cual harían inviable las prestaciones anunciadas:

Sus cifras son 200 kwh de batería, tiene una velocidad punta de más de 400 km/h, autonmía de mas de 1000km, acelera de 0-60 mph (0-97 km/h) en 1,9 segundos y de 0-100 mph (0-161 km/h) en 4,2 segundos, recorriendo un cuarto de milla (402 m) en 8,9 segundos.

